Ionisasi zat elektrolit, kelas X
Assalamualikum..
Hari ini kita akan melanjutkan materi kita yaitu penulisan persamaan reaksi ionisasi, yang mana pertemuan sebelumnya kita sudah membahas pengertian larutan elektrolit dan non elktrolit dan membedakan larutan elektrolit kuat dan lemah.
Diharapkan dari pembelajaran kita hari ini kalian dapat menuliskan persamaan reaksi ionisasi zat elektrolit dengan benar.
Teori ion Svante Arrhenius
Penjelasan yang dikemukakan oleh svante August Arrhenius (1859-1927), seorang ahli kimia swedia, yaitu tahun 1887. Menurut Arrhenius , larutan elektrolit dapat menghantarkan listrik karena mengandung ion-ion yang dapat bergeerak bebas. Ion –ion itulah yang menghantarkan arus listik melalui larutan.
Masih ingatkah anda mengenai senyawa ion? Senyawa ion merupakan senyawa yang tersusun atas ion ion positif dan ion ion negative yang terikat oleh gaya elektrostatis. Senyawa ion umumnya berupa padatan kristal, di mana ion-ionnya terikat satu sama lain dengan kuat dan rapat.
Salah satu contoh senyawa ion adalah NaCl. Ketika senyawa NaCl dilarutkan dalam air, maka ion ion yang ada dalam senyawa akan terurai (dissosiasi) menyebar dalam pelarut. Seperti yang sudah kita pelajari bahwa air merupakan pelarut yang efektif untuk melarutkan senyawa ion. Air memiliki kutub polar positif dan negatif sehingga cukup kuat untuk menarik ion ion dari kristal NaCl.
|
Dalam bentuk padatan senyawa ion tidak dapat menghantarkan arus listrik karena ion-ionnya tidak dapat bergerak bebas. Dalam bentuk lelehan maupun larutan, ion-ionnya dapat bergerak bebas sehingga lelehan dan larutan senyawa ion dapat menghantarkan arus listrilk
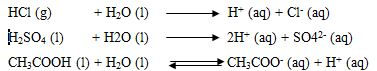
Selain senyawa ion, beberapa senyawa kovalen polar dapat terurai menjadi ion ionnya (terionisasi) dalam pelarut air, contohnya HCl, H2SO4, CH3COOH.Beberapa senyawa tersebut dapat terionisasi dalam air seperti dijelaskan dalam reaksi ionisasi berikut ini.
Dapat disimpulkan bahwa senyawa kovalen polar yang dapat terionisasi merupakan dalam air akan membentuk larutan elektrolit.
Keterangan: (g) =fase gas, (l)= liquit atau cair, (aq)=larutan
Untuk larutan non-elektrolit kita ambil contoh senyawa sukrosa (C12H22O11).Senyawa C12H22O11 termasuk jenis senyawa kovalen polar.Apa yang terjadi dengan senyawa C12H22O11 jika dilarutkan kedalam air? Senyawa tersebut hanya akan terurai menjadi molekul molekulnya saja tidak menjadi ion ionnya. Bila dalam larutan tidak terdapat ion-ion yang bergerak bebas, artinya larutan tersebut akan sangat sukar menghantarkan arus listrik. Jadi, larutan C12H22O11 merupakan larutan non-elektrolit.


Komentar
Posting Komentar