Kelas 11 IPS 2, Faktor laju reaksi
Guru mapel : Siti maysaroh
Mapel : Kimia
Kelas : XI ips 2
Materi : Faktor- faktor yang mempengaruhi laju reaksi
Materi sebelumnya yang kita bahas adalah pengertian laju reaksi dan penulisan persamaan laju reaksi, nah hari ini kita lanjutkan untuk faktor-faktor yang mempengaruhi laju reaksi.
Apa sih manfaatnya dalam kehidupan kita untuk materi laju reaksi, nah salah satunya adalah lemari es atau yang kita kenal dengan' kulkas' jadi kulkas merupak alat pendingin yang dibuat bertujuan penerapan konsp faktor laju reaksi yaitu faktor suhu. Nah berikut adalah faktor-faktor yang mempengaruhi laju reaksi.
Materi
1. PengaruhLuasPermukaanTerhadapLajuReaksi
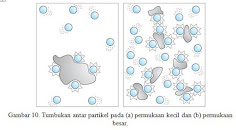
Pada saat zat-zat pereaksi bercampur, maka akan terjadi tumbukan antar partikel pereaksi di permukaan zat. Laju reaksi dapat diperbesar dengan memperluas permukaan bidang sentuh zat yang dilakukan dengan cara memperkecil ukuran zat pereaksi. Perhatikan Gambar 10.
Semakin luas permukaan bidang sentuh zat, semakin besar laju reaksinya, seperti yang ditunjukkan oleh grafik hubungan luas permukaan dengan laju reaksi pada Gambar 11.
Semakin besar luas permukaan zat padat yang direaksikan semakin lambat laju reaksinya.Namun,semakin kecil luas permukaan zat padat yang direaksikan semakin cepat laju reaksi yang terjadi. Hal tersebut terjadi karena dalam reaksi partikel dalam bentuk cair bertumbukan dengan partikel padat, peningkatkan luas permukaan dari zat padat meningkatkan kemungkinan tumbukan bertambah besar.Peningkatan jumlah tumbukan per detik meningkatkan laju reaksi.
2. PengaruhKonsentrasiterhadapLajuReaksi
Jika konsentrasi suatu larutan makin besar, larutan akan mengandung jumlah partikel semakin banyak sehingga partikel-partikel tersebut akan tersusun lebih rapat dibandingkan larutan yang konsentrasinya lebih rendah. Susunan partikel yang lebih rapat memungkinkan terjadinya tumbukan semakin banyak dan kemungkinan terjadi reaksi lebih besar. Makin besar konsentrasi zat, makin cepat laju reaksinya. Perhatikan Gambar 8. tentang pengaruh konsentrasi berikut.
Apabila dibuat sebuah grafik yang menunjukkan hubungan antara konsentrasi dengan laju reaksi, maka dihasilkan grafik seperti pada Gambar 9. Grafik menunjukkan bahwa semakin besar konsentrasi, semakin cepat pula laju reaksinya.
Berdasarkan gambar diatas dapat dilihat bahwa konsentrasi pereaksi berkaitan dengan jumlah partikel zat yang terlibat dalam tumbukan. Bila pereaksi bertambah, maka jumlah partikel-partikel yang bertumbukan akan semakin banyak/meningkat. Dengan demikian jarak antara partikel.zat tersebut menjadi lebih dekat dan jumlah tumbukkan efektif juga akan meningkat. Hal ini berarti terjadi peningkatan laju suatu reaksi. Dan sebaliknya, jika konsentrasi berkurang, maka tumbukan akan sedikit dan laju reaksi juga akan berkurang.
3. PengaruhSuhuTerhadapLajuReaksi
Partikel-partikel dalam zat selalu bergerak. Jika suhu zat dinaikkan, maka energi kinetik partikel-partikel akan bertambah sehingga tumbukan antar partikel akan mempunyai energi yang cukup untuk melampaui energi pengaktifan. Hal ini akan menyebabkan lebih banyak terjadi tumbukan yang efektif dan menghasilkan reaksi (Gambar 12).
Pada umumnya, setiap kenaikan suhu sebesar 10 oC, reaksi akan berlangsung dua kali lebih cepat. Dengan demikian, apabila laju reaksi awalnya diketahui, kita dapat memperkirakan besarnya laju reaksi berdasarkan kenaikan suhunya.
Panas menyediakan energi untuk mengubah partikel yang tidak aktif menjadi aktif. Partikel tidak aktif berada pada tingkat energi yang rendah. Energi yang dibutuhkan untuk mengubah partikel-partikel tidak aktif menjadi partikel-partikel aktif disebut dengan energi aktifasi. Pada temperatur tertentu suatu partikel memiliki energi kinetik , ada yang memiliki energi kinetik rendah ada juga yang memiliki energi kinetik yang tinggi.
Menurut teori kinetik gas, molekul-molekul dalam satu wadah tidaklah mempunyai energi yang sama, tetapi bervariasi menurut kurva yang mendekati kurva normal. Sebagian besar molekul mempunyai energi ratra-rata. Peningkatan suhu akan menaikkan energi rata-rata molekul, sehingga jumlah atau fraksi molekul yang mencapai energi pengaktifan bertambah, sehingga laju reaksinya akan meningkat. Umumnya kenaikan suhu sebesar 100C menyebabkan kenaikan laju reaksi sebesar dua sampai tiga kali. Kenaikan laju reaksi ini dapat dijelaskan dari gerak molekulnya.
Alasan kenaikan suhu suatu reaksi menyebabkan energi aktivasi (Ea ) menjadi turun dijelaskan oleh Svante Arrhenius dengan menggunakan persamaan hubungan suhu dengan energi aktivasi.
4. PengaruhKatalisTerhadapLajuReaksi
Pengaruh Katalis terhadap laju reaksi
Katalis merupakan suatu zat yang memiliki kemampuan untuk membantu jalannya suatu reaksi kimia. Jumlah katalis pada awal dan akhir reaksi akan tetap sama. Sedangkan energi aktivasi sendiri adalah energi minimum yang harus dicapai oleh suatu senyawa kimia untuk melakukan atau bereaksi secara kimia.
Suatu reaksi kimia akan berlangsung apabila terjadi tumbukan – tumbukan antar partikel dengan energi yang cukup, energi inilah yang disebut dengan energi aktivasi. Tidak semua partikel – partikel pada senyawa kimia dapat bereaksi satu sama lain, hanya partikel – partikel yang memiliki energi aktivasi yang cukup sajalah yang dapat melakukan reaksi, sebagian besar partikel – partikel tersebut tidak memiliki energi aktivasi yang cukup. Nah, untuk kondisi seperti ini diperlukan suatu zat yang memungkinkan semua partikel mencapai energi aktivasinya agar dapat bereaksi satu sama lain, agar laju reaksi menjadi lebih besar. Penambahan katalis sangat diperlukan pada kondisi yang seperti ini, penambahan katalis memberikan perubahan yang berarti pada energi aktivasi. Katalis menyediakan rute khusus untuk jalannya suatu reaksi, jalur khusus ini memiliki energi aktivasi yang rendah, sehingga dapat meningkatkan tumbukan – tumbukan antar partikel. Akibatnya laju reaksi menjadi lebih besar.
Demikian lah faktor-faktor laju reaksi. Berdasrkan uraian tersebut buatlah kesimpulan terhadap faktor-faktor laju reaksi.









Komentar
Posting Komentar