Kelas 10 IPA 3, Konsep mol
Konsep Mol, Massa Molar dan Volume Molar
Diperlukan suatu konversi yang menghitung jumlah partikel yang kita ukur. Dalam ilmu kimia, konversi tersebut dikenal dengan mol. Satu mol didefinisikan sebagai banyaknya suatu zat (gram/L) yang mengandung identitas dasar berupa atom, mol, atau partikel lain sebanyak atom yang terdapat dalam 12 gram atom C-12, sedangkan massa 1 atom C-12 adalah 1,999268 x 10-23
Jadi standar mol adalah 12 gram C-12. Melalui berbagai percobaan, Loscmith menemukan Jumlah partikel yang terdapat dalam 12 gram atom C-12 yaitu:
Artinya, bahwa dalam 1 mol terdapat 6,02 x 1023partikel, yang selanjutnya disebut bilangan Avogadro yang dinyatakan dengan lambang L.
Terdapat hubungan jumlah mol dengan jumlah partikel yaitu sebagai berikut:
Jumlah partikel = jumlah mol x bilangan Avogadro
n = mol
Sedangkan hubungan mol dengan massa zat yaitu sebagai berikut:
n= mol,
mm= masa molar atau Mr
Contoh:
1. Untuk membuat 2 mol urea diperlukan berapa gram pupuk urea? Jika diketahui masa molekul relatif urea adalah 60.
Jawab:
massa = mol x Mr
= 2 x 60
= 120 gram
2. Dalam 50 gram HF, terdapat berapa molkah senyawa HF tersebut Jika diketahui Mr HF=19.
Jawab:
massa = Mol x Mr
Mol = massa/ Mr
= 50 /19
=2,63 mol
UJI KEPAHAMAN:
1. Tentukanlah mol dari 80 gram sukrosa, Mr sukrosa adalah 180.
2. Tentukan massa garam NaCl yang terdapat dalam 3 mol garam dapur teesebut, jika Mr NaCl adalah 58,5






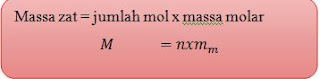

Alya anugrah ningtyas
BalasHapusX ipa 3
Najwa Dian Azzahra
BalasHapusX IPA 3
Sanes Nata Negara
BalasHapusX IPA 3
Bunga Sri Wulandari
BalasHapusX IPA 3
Cantika Laras
BalasHapusX Ipa 3
jeani Dwi Aulia
BalasHapusX IPA 3
Kharisma Mustika Sari
BalasHapusX IPA 3
Putri oktavia
BalasHapusX IPA 3
M Ifris Putra L
BalasHapusX IPA 3
Ammar Faishal
BalasHapusX ipa 3
Tiur Aulia m
BalasHapusX ipa 3
Alifa Diva Yusmutia
BalasHapusX ipa 3
Farrel Eka Sampurna
BalasHapusX ipa 3
Haikal rasya Abdul m
BalasHapusX ipa 3
Ahmat andri firmansyah
BalasHapusX ipa 3
Azka lulu fatikah
BalasHapusX ipa 3
M Ifris Putra L
BalasHapusX IPA 3
Nila oktavia
BalasHapusX ipa3
Fika Nova Cahya Maharani
BalasHapusX IPA 3
Asa aulia f
BalasHapusX IPA 3
Nasywa Lindi ayma
BalasHapusX IPA 3