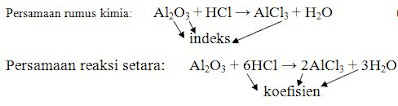
Assalamualaikum anak-anaku sekalian... Hari ini kita akan melanjutkan materi kita yaitu membedakan larutan elektrolit kuat dan elektrolit lemah, yang mana pertemuan sebelumnya kita sudah membahas pengertian larutan elektrolit dan non elktrolit beserta ciri-cirinya. Diharapkan dari pembelajaran kita hari ini kalian dapat membedakan larutan elektrolit kuat dengan elektrolit lemah berdasarkan ciri-cirinya, serta dapat menyebutkan zat-zat yang termasuk senyawa elektrolit kuat dan elektrolit lemah. LARUTAN ELEKTROLIT DAN NON ELEKTROLIT Sekarang kita sudah mengetahui jawaban dari pertanyaan mengenai kegiatan memancing dengan ikan , Nah, sekarang kita akan coba membahas lebih mendalam apa saja yang terjadi ketika senyawa elektrolit dilarutkan dalam air sehingga larutan tersebut dapat menghantarkan arus listrik. I. Berdasarkan daya hantar listriknya, larutan terbagi 2, yaitu : a. Larutan elektrolit Adalah larutan yang dapat menghantarkan arus listrik. ...