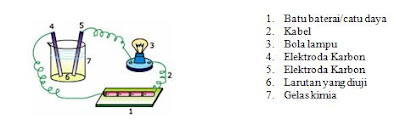
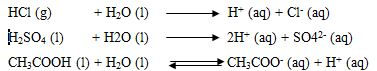
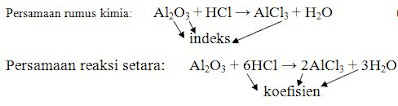
Tata nama senyawa alkohol, Kleas XII ips1
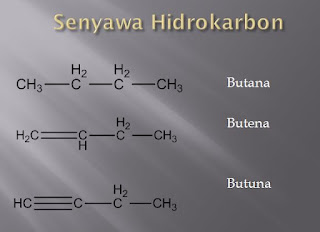
ALKANOL Senyawa alkanol sudah banyak di kenal dan di manfaatkan oleh manusia, baik dalam bentuk minuman,makanan,maupun untuk keperluan medis. Berdasarkan tabel di atas, terlihat adanya perbedaan alkana dan alkanol. Alkanol merupakan senyawa karbon yang mengandung gugus fungsi –OH. Sehingga rumus struktur senyawa alkanol adalah R-OH, dengan R merupakan alkil yang mengikat alkohol dan –OH merupakan gugus fungsi senyawa alkanol. Tata nama senyawa alkanol Nama IUPAC alkohol diambil dari nama alkana rantai induknya, tetapi dengan akhiran –ol. Berikut ini aturan tata nama IUPAC alkanol (Alkohol) secara rinci: 1. Nama alkohol disebut seperti alkana dengan mengganti akhiran a dengan akhiran –ol 2. Letak gugus –OH diberi nomor sesuai dengan nomor atom C yang mengikatnya 3. Pemberian nomor atom karbon diusahakan agar gugus –OH mendapat nomor sekecil mungkin 4. Urutan penyebutannya adalah: nomor cabang dan nama cabang (jika ada) – nomor letak gugus –OH – nam