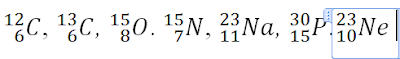Kelas 10 IPA1 UB1
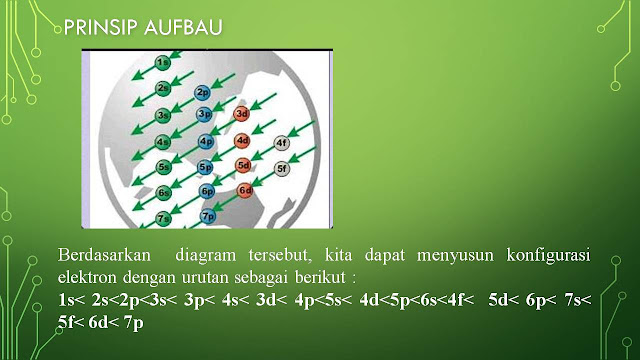
Assalamualaikum... anak-anakku sekalian hari ini kalian UB 1 ya, untuk materi mulai dari pengenalan kimia sampai dengan notasi atom ya. Kalian akan mengerjakan langsung di google forms, jadi nanti kalian dapat melihat langsung skor nilai kalian ya. Untuk Link dan token akan ibu kirimkan di grup kelas sesuai jam pelajaran ya. Saat pengerjaan soal kalian diperbolehkan melihat catatan ya, tapi tidak diperkenankan searching jawaban dari internet. Kerjakan dengan sungguh-sungguh ya, semangattt....