Kelas 10 IPA 3, Hukum dalton dan Hukum Gay-Lussac
Assalamualaikum anak-anaku sekalian...
Guru bidang study : Siti Maysaroh, S.Pd
Mata pelajaran : Kimia
Kelas : X IPA
KD : Menerapkan hukum-hukum dasar kimia, konsep massa molekul relatif, persamaan kimia, konsep mol, dan kadar zat untuk menyelesaikan perhitungan kimia
Hukum Perbandingan Berganda ( Hukum Dalton)
Komposisi kimia ditunjukkan oleh rumus kimianya. Dalam senyawa, seperti air, dua unsur bergabung dan masing-masing menyumbangkan sejumlah atom tertentu untuk membentuk suatu senyawa. Dari dua unsur dapat dibentuk beberapa senyawa dengan perbandingan berbeda-beda. Hukum Proust dikembangkan lebih lanjut oleh para ilmuwan untuk unsur-unsur yang dapat membentuk lebih dari satu jenis senyawa. Salah seorang diantaranya adalah John Dalton (1766 – 1844). Dalton mengamati adanya suatu keteraturan yang terkait dengan perbandingan massa unsur-unsur dalam suatu senyawa.
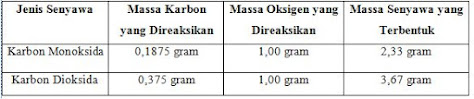
Untuk memahami hal ini, perhatikan tabel hasil percobaan reaksi antara karbon dengan oksigen berikut
Dengan massa oksigen yang sama, ternyata perbandingan massa karbon dalam senyawa karbon monoksida dan senyawa karbon diksida merupakan bilangan bulat dan sederhana.
Massa karbon dalam senyawa karbon dioksida : massa karbon dalam senyawa karbon monoksida = 0,375 : 0,1875 = 2:1
Berdasarkan hasil percobaannya, Dalton merumuskan hukum kelipatan perbandingan (hukum Dalton) yang berbunyi: " Jika dua jenis unsur bergabung membentuk lebih dari satu senyawa, dan jika massa salah satu unsur dalam senyawa-senyawa tersebut sama, sedangkan massa unsur lainnya berbeda, maka perbandingan massa unsur lainnya dalam senyaw-senyawa tersebut merupakan bilangan bulat dan sederhana".
Uji kepahaman:
Unsur nitrogen dan oksigen dapat membentuk lebih dari satu senyawa, misalnya NO, NO2, N2O3, dan N2O4. Pada kondisi tertentu, 1 g nitrogen tepat bereaksi dengan 1,14 g oksigen. Pada kondisi yang lain, 1 g nitrogen tepat bereaksi dengan 2,28 g oksigen. Jelaskan bahwa data ini sesuai dengan Hukum Perbandingan Berganda
Gay-Lussac melakukan percobaan dengan cara mencampurkan gas hidrogen dan gas oksigen ke dalam suatu wadah tertentu, kemudian terhadap campuran dilewatkan bunga api listrik agar terjadi reaksi. Hasil reaksi dan gas hasil reaksi dipisahkan berdasarkan perbedaan titik cair komponen campuran dengan cara mengubah fasa uap menjadi cair. Dengan demikian, volume gas-gas sisa reaksi dan hasil reaksi dapat dipisahkan dan diukur. Percobaan tersebut dilakukan berulangkali pada suhu dan tekanan tetap. Hasil pengukuran menunjukan bahwa perbandingan volume gas hidrogen dan oksigen yang bereaksi dan uap air produk reaksi selalu 2:1:2, atau
2 volum gas hidrogen + 1 volum gas oksigen –> 2 volum uap air
Berdasarkan data perbandingan volum, Gay-Lussac sampai pada kesimpulan bahwa pada suhu dan tekanan tetap, volume gas-gas yang bereaksi dan volum gas-gas hasil reaksi berbanding sebagai bilangan bulat dan sederhana. Pernyataan ini dikenal dengan nama Hukum Gay Lussac atau juga dikenal Hukum Perbandingan Volume
Pada kondisi temperatur dan tekanan yang sama, perbandingan volume gas-gas pereaksi dengan gas-gas hasil reaksi merupakan bilangan yang bulat dan sederhana.
Suatu persamaan reaksi kimia yang menyatakan terlibatnya suatu pereaksi atau hasil reaksi yang berwujud gas memiliki koefisien reaksi sehingga jumlah atom-atom pereaksi dan hasil reaksi dalam persamaan reaksi tersebut setara.
Koefisien reaksi dalam persamaan reaksi tersebut menyatakan perbandingan volume gas pada temperatur dan tekanan yang sama. Perhitungan volume gas-gas pereaksi atau hasil reaksi berdasarkan Hukum Gay Lussac juga dapat dinyatakan:
"Perbandingan koefisien dalam reaksi kimia = perbandingan volume (pada suhu dan tekanan yang sama)"



Kharisma Mustika Sari
BalasHapusX IPA 3
Yunita sari
BalasHapusX Ipa 3
Bunga Sri Wulandari
BalasHapusX IPA 3
Najwa Dian Azzahra
BalasHapusX IPA 3
M Ifris Putra L
BalasHapusX IPA 3
Putri Oktavia
BalasHapusX IPA 3
Tiara intan
BalasHapusX IPA 3
Cantika Laras
BalasHapusX IPA 3
Ayu undari
BalasHapusX IPA 3
Yeni sri mulyani
BalasHapusx ipa 3
Dina Nurmala Hayati
BalasHapusX IPA 3
Nabila Putri Selina
BalasHapusX IPA 3
Alya anugrah ningtyas
BalasHapusX ipa 3
Sanes Nata Negara
BalasHapusX IPA 3
Komentar ini telah dihapus oleh pengarang.
BalasHapusAmmar Faishal
BalasHapusX ipa 3
Gitakurnia
BalasHapusX ipa 3
Azka lulu fatikah
BalasHapusX ipa 3
Nila oktavia
BalasHapusX ipa3