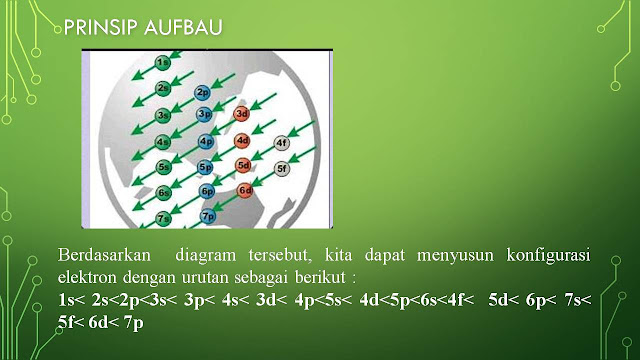
Kelas 10 IPA 1,3 Materi Kamis tanggal 17 Sept 2020, Menentukan letak golongan suatu unsur dalam tabel periodik
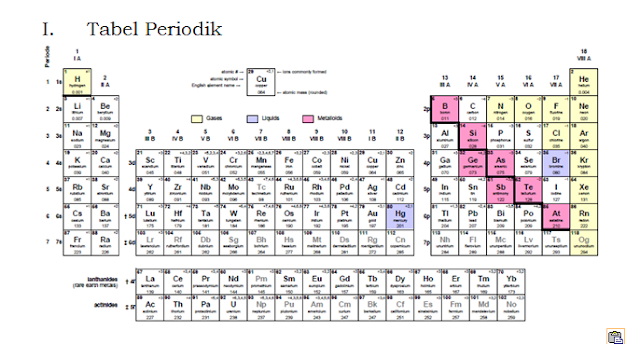
Menentukan letak golongan dan periode suatu unsur dalam tabel periodik: Selain dengan cara menghafal letak unsur dalam tabel periodik, kita juga dapat menentukan letak unsur dalam Sistem Periodik Unsur (spu) melalui konfigurasi elektronnya. Sebelum dapat menentukan letak golongan dan periode suatu usur dalam tabel periodik kita harus tau istilah Golongan dan Periode. GOLONGAN Golongan = lajur Vertikal (bagian dari atas kebawah) = jumlah elektron valensinya. Golongan dibagi 2: Golongan A ( Utama) dan Golongan B (Logam Transisi). Disebut Golongan A bila pada konfigurasi elektronnya berakhir di sub kulit s atau p. Disebut golongan B bila pada konfigurasi elektronnya berakhir disub kulit d. PERIODE Periode = lajur Horizontal = jumlah kulit ( angka terbesar depan huruf). Contoh : 1. Tentukan letak unsur 17 Cl dalam tabel periodik konfigurasi elektron 17 Cl :1 s 2 2s 2 2 p 6 3s 2 3p 5 karena sub kulit (orbital) terakhirnya p maka ter...