Kelas 10 IPS3, hukum Dalton
Assalamualaikum anak-anaku sekalian...
Guru bidang study : Siti Maysaroh, S.Pd
Mata pelajaran : Kimia
Kelas : X IPS 3
Materi : Hukum - hukum dasar kimia
KD : Menerapkan hukum-hukum dasar kimia, konsep massa molekul relatif, persamaan kimia, konsep mol, dan kadar zat untuk menyelesaikan perhitungan kimia
Tujuan Pembelajaran: Diharapkan setelah mempelajari materi hukum Dalton siswa mengetahui bahwa jika dua jenis unsur dapat membentuk lebih dari satu senyawa.
Hukum Perbandingan Berganda ( Hukum Dalton)
Komposisi kimia ditunjukkan oleh rumus kimianya. Dalam senyawa, seperti air, dua unsur bergabung dan masing-masing menyumbangkan sejumlah atom tertentu untuk membentuk suatu senyawa. Dari dua unsur dapat dibentuk beberapa senyawa dengan perbandingan berbeda-beda. Hukum Proust dikembangkan lebih lanjut oleh para ilmuwan untuk unsur-unsur yang dapat membentuk lebih dari satu jenis senyawa. Salah seorang diantaranya adalah John Dalton (1766 – 1844). Dalton mengamati adanya suatu keteraturan yang terkait dengan perbandingan massa unsur-unsur dalam suatu senyawa.
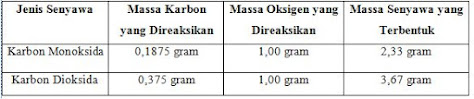
Untuk memahami hal ini, perhatikan tabel hasil percobaan reaksi antara karbon dengan oksigen berikut
Dengan massa oksigen yang sama, ternyata perbandingan massa karbon dalam senyawa karbon monoksida dan senyawa karbon diksida merupakan bilangan bulat dan sederhana.
Massa karbon dalam senyawa karbon dioksida : massa karbon dalam senyawa karbon monoksida = 0,375 : 0,1875 = 2:1
Berdasarkan hasil percobaannya, Dalton merumuskan hukum kelipatan perbandingan (hukum Dalton) yang berbunyi: " Jika dua jenis unsur bergabung membentuk lebih dari satu senyawa, dan jika massa salah satu unsur dalam senyawa-senyawa tersebut sama, sedangkan massa unsur lainnya berbeda, maka perbandingan massa unsur lainnya dalam senyaw-senyawa tersebut merupakan bilangan bulat dan sederhana".
Uji kepahaman:
Unsur nitrogen dan oksigen dapat membentuk lebih dari satu senyawa, misalnya NO, NO2, N2O3, dan N2O4. Pada kondisi tertentu, 1 g nitrogen tepat bereaksi dengan 1,14 g oksigen. Pada kondisi yang lain, 1 g nitrogen tepat bereaksi dengan 2,28 g oksigen. Jelaskan bahwa data ini sesuai dengan Hukum Perbandingan Berganda


Kartika Aprilia
BalasHapusX IPS 3
Mutia Az Zahra
BalasHapusX IPS 3
Rieke Naurah Kayana
BalasHapusX IPS 3
Raisa khairunnisa ghassani
BalasHapusX IPS 3
Ammara Dara Aisyah
BalasHapusX IPS 3
Farhatul ummi
BalasHapusX IPS 3
Fadhlan Satria Ahmad
BalasHapusX IPS 3
Komentar ini telah dihapus oleh pengarang.
BalasHapusM Dzaki Hirzi
BalasHapusX IPS 3
Damara Khadafi
BalasHapusX IPS 3